RealPure普通植物RNA提取試劑盒
RealPure
Plant RNA Extraction Kit for Conventional
Plants
|
貨號
|
名稱
|
規(guī)格
|
|
RTR2302
|
RealPure普通植物RNA提取試劑盒
|
50次
|
● 試劑盒內(nèi)容及保存:
|
試劑盒組成
|
RTR2302-01 (50次)
|
貯存
|
|
裂解液RL
|
30
ml
|
常溫
|
|
裂解液RL
plus
|
30
ml
|
常溫
|
|
去蛋白液RD
|
30
ml
|
常溫
|
|
漂洗液RW(濃縮液)
|
25
ml
首次使用按照標(biāo)簽加入無水乙醇
|
常溫
|
|
RNase-free水
|
5
ml
|
4℃
|
|
DNA清除柱CS(RNase-free)
|
50個(gè)
|
常溫
|
|
RNA吸附柱CR(RNase-free)
|
50個(gè)
|
常溫
|
|
收集管
|
100個(gè)
|
常溫
|
|
2
ml離心管(RNase-free)
|
50個(gè)
|
常溫
|
|
1.5
ml離心管(RNase-free)
|
150個(gè)
|
常溫
|
|
說明書
|
1份
|
|
● 儲存條件和效期:
RNase-free水4℃保存��;其他試劑在常溫(25℃左右)干燥條件下�,可保存1年。試劑盒常溫運(yùn)輸�����。
● 產(chǎn)品簡介:
本試劑盒可從普通植物(擬南芥���,水稻��,小麥����,煙草����,玉米��,綠蘿等)葉片����、莖、幼苗��、果肉中快速提取總RNA,可同時(shí)處理大量不同樣品�����,20-30分鐘內(nèi)即可完成反應(yīng)����,提取的總RNA純度高,沒有DNA和蛋白的污染����,可用于Northern
blot、Dot blot��、polyA
篩選��、體外翻譯�、RNase 保護(hù)分析和分子克隆等實(shí)驗(yàn)。
由于植物材料的復(fù)雜性��,該試劑盒不能提取多糖多酚植物RNA�����,也不能有效提取植物種子����、塊莖�、鱗莖的RNA�,提取這些材料的RNA請選擇RealPure多糖多酚植物RNA提取試劑盒(Cat:RTR2304)和RealPure植物種子RNA提取試劑盒(Cat:RTR2308)。
● 準(zhǔn)備工作:
1操作前在裂解液RL中加入β-巰基乙醇至終濃度1%����,如500
μl RL中加入5 μl β-巰基乙醇。此裂解液最好現(xiàn)用現(xiàn)配����。配好的
RL4 ℃可放置3天。
2
按照標(biāo)簽所示在漂洗液RW中加入無水乙醇(自備)����,混勻后蓋緊瓶蓋后室溫貯存?zhèn)溆谩?
3
所有離心步驟均在常溫下進(jìn)行。
● 操作步驟:
1. 樣品處理:
1.1 1.5 ml離心管中加入500 μl裂解液RL(使用前請先檢查是否已加入β-巰基乙醇)��。
注:多糖多酚植物(如銀杏����,毛白楊等)使用該試劑盒不能提取RNA�,請選擇RealPure多糖多酚植物RNA提取試劑盒(Cat:RTR2304)。
背景知識:快速判斷是否為多糖多酚植物
取20mg左右的植物材料�����,放入1.5 ml離心管中,加入0.5 ml 0.2 M
NaOH溶液�����,95℃ 10分鐘�,觀察裂解物顏色。顏色為綠色或淡黃色為普通植物��;顏色為棕黃色或棕紅色為多糖多酚植物�。
1.2將植物材料加入到液氮預(yù)冷的研缽中,用研杵研磨�����,其間不斷加入液氮���,直至研磨成粉末狀���。取50 mg粉末迅速加入到離心管中,渦旋劇烈震蕩混勻����,常溫放置5分鐘�。
注:一定不要加入超過50 mg的粉末��,否則樣品超過裂解液RL的裂解能力會導(dǎo)致RNA提取失敗�。
背景知識:樣品處理量絕對不要超過RNA吸附柱處理能力,否則造成RNA殘留或者產(chǎn)量降低���。不同植物組織種類RNA相差極大��,例如有些植物種子RNA含量較高����,玉米種子RNA含量可達(dá)50 μg/50 mg種子���,超過50 mg材料會超過吸附柱吸附能力����,導(dǎo)致提取失敗��。所以開始摸索實(shí)驗(yàn)條件時(shí)���,如果不清楚樣品RNA含量時(shí)寧可使用較少的樣品處理量,如植物組織不超過50 mg��,隨后根據(jù)實(shí)驗(yàn)結(jié)果增加或者減少處理量。
2. 離心取上清:
13,000 rpm離心5
min���,小心吸取收集管中的上清至1.5 ml RNase-free的離心管中���,吸頭盡量避免接觸收集管中的細(xì)胞碎片沉淀。一般可獲得400 μl上清��。
3. 去除基因組污染:
上清中加入0.5倍體積的無水乙醇(如400 μl上清中加入200 μl無水乙醇)�,混勻(此時(shí)可能會出現(xiàn)沉淀),得到的溶液和沉淀一起轉(zhuǎn)入DNA清除柱CS(清除柱放入收集管中)中��,13,000 rpm離心2分鐘�,棄掉收集管中的廢液。
注:確保全部溶液都收集到收集管中�����,如果膜上有殘留液體���,延長離心時(shí)間至5分鐘���,保證膜上無殘留液體。
4. 洗脫RNA:
將DNA清除柱放入一干凈的2 ml離心管中����,在清除柱中加入500 μl 裂解液RL
plus�,13,000 rpm離心1分鐘���,收集濾液(注意:RNA在濾液中����,不要丟棄)�����,濾液中加入250 μl無水乙醇���,此時(shí)可能會出現(xiàn)沉淀��,立即混勻�,不要離心�。
5. RNA掛柱:
將全部溶液加入到RNA吸附柱CR中(吸附柱放入收集管中),13,000 rpm離心2分鐘�。
注:確保溶液全部過濾到收集管中,膜上無殘留���,如有必要��,可以延長離心時(shí)間至5分鐘��。
6. 去除RNA中的蛋白污染:
向RNA吸附柱CR中(吸附柱放入收集管中)加入500 μl 去蛋白液RD����,13,000
rpm離心1分鐘����,棄廢液。
7. 去除RNA中的其他雜質(zhì):
向RNA吸附柱CR中加入700
μl漂洗液RW(使用前請先檢查是否已加入乙醇)�, 13,000 rpm離心1分鐘,棄廢液�����。
8. 進(jìn)一步去除RNA中的其他雜質(zhì):
向吸附柱CR中加入500
μl漂洗液RW (使用前請先檢查是否已加入乙醇)��,13,000 rpm離心1
分鐘���,棄廢液����,將吸附柱CR放回收集管中,確保蓋好吸附柱管蓋�����。
9. 關(guān)鍵步驟:徹底去除吸附柱上的殘余乙醇:
13,000 rpm將吸附柱CR空甩離心2 分鐘��,去除吸附柱上的殘余液體��。
注:此步驟目的是將吸附柱中殘余的漂洗液去除�����,如果有漂洗液殘留�����,可能會影響后續(xù)的RT等實(shí)驗(yàn)操作����。
10. 洗脫得到RNA:
將RNA吸附柱CR轉(zhuǎn)入一個(gè)新的1.5 ml RNase-free離心管中,向吸附柱O型墊圈中央懸空加入50-100 μl RNase-free水(事先65℃預(yù)熱可提高洗脫效率)�����,蓋好吸附柱管蓋�����,常溫放置2分鐘,13,000
rpm離心2 分鐘���。
注:確保水要加到膜的中央,不要貼壁加入����;洗脫緩沖液體積不應(yīng)少于50 μl,體積過小影響回收效率����。
11. RNA貯存:
RNA樣品-80℃中保存。
● RNA產(chǎn)量和質(zhì)量的評估:
1. RNA產(chǎn)量:
用分光光度計(jì)測定OD260的吸光值來計(jì)算RNA產(chǎn)量����。將RNA按照一定的比例稀釋于TE溶液(10mMTris pH8.0,1mMEDTA)中�����,根據(jù)以下公式計(jì)算:
A260×稀釋倍數(shù)×40=μg
RNA/ml
注:測定OD值時(shí)�,盡量不要用RNase-free水稀釋RNA,因?yàn)镽Nase-free水pH較低����,測定的OD值偏低��。
2. RNA質(zhì)量:
凝膠電泳檢測:凝膠電泳中����,完整的RNA應(yīng)該有兩條主帶:28S和18S����,并且28S亮度應(yīng)該與18S相當(dāng)或是其亮度的2倍??梢允褂闷胀ǖ?×TAE瓊脂糖凝膠電泳,凝膠濃度1-1.5
%�����,可以使用高電壓��,短時(shí)間電泳����,如7V/cm電泳,20分鐘���。建議使用D2000
DNA ladder(Cat:RTM415)作為Marker����。植物28S rRNA遷移率與1500bp類似,18S rRNA遷移率與1000bp類似�。
吸光值檢測:可以用A230,A260和A280的數(shù)值表示RNA的純度����。純凈的RNA的
A260/A280比值應(yīng)該為2,我們得到的RNA樣品比值應(yīng)在1.8-2.2之間���,如果比值低于1.8,表明RNA樣品中蛋白污染比較嚴(yán)重�。A260/A230比值應(yīng)該在2-2.2之間。如果此比值低于2�����,表明RNA樣品中有胍鹽�,多糖的污染。
● 實(shí)驗(yàn)示例:
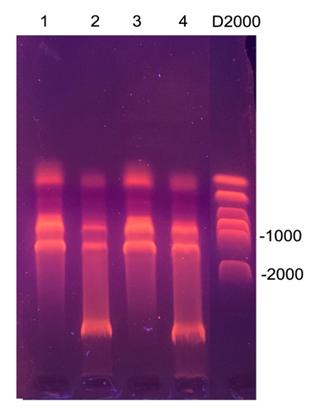
綠蘿葉片RNA
1���,3 使用了DNA清除柱
2�����,4未使用DNA清除柱
1% 瓊脂糖凝膠 1×TAE 150V
20min
|
● 問題指南:
1. 離心柱發(fā)生堵塞
離心柱發(fā)生堵塞之后會造成
RNA 得率降低甚至不能純化得到
RNA���。
常見原因分析如下:
1.1:樣本破碎不徹底���。
樣本破碎不徹底會使吸附柱發(fā)生堵塞,同時(shí)會影響
RNA 得率及質(zhì)量�����。我們建議在進(jìn)行樣本破碎的時(shí)候����,在足量的液氮中快速研磨操作,盡量破碎樣本細(xì)胞壁���、細(xì)胞膜等組織��。
1.2 樣本初始量過多�。
樣本使用量過多會導(dǎo)致裂解液RL或裂解液RSL裂解細(xì)胞時(shí)不完全���,導(dǎo)致離心柱堵塞�����。RealPure植物RNA提取試劑盒處理樣本的初始最大量為50
mg�。
1.3 離心機(jī)的溫度過低。
整個(gè)
RNA 分離純化除了液氮破碎樣本組織外��,所有的步驟均在常溫(20-25℃)進(jìn)行���。有些低溫離心機(jī)的溫度低于 20℃���,可能會造成離心柱的堵塞。如果發(fā)生這種現(xiàn)象��,請將離心機(jī)溫度設(shè)置到
20-25℃��。
2. 提取不到RNA或者RNA產(chǎn)量低
通常會有多種因素影響回收效率�,比如:樣本
RNA 含量���、操作方法�、洗脫體積等���。
常見原因分析:
2.1 樣本保存不當(dāng)或樣本保存時(shí)間過久導(dǎo)致RNA
已經(jīng)降解�����。
建議:新采集的樣本應(yīng)立即放入液氮中速凍��,長期保存于-70℃并避免樣本的反復(fù)凍融��;或者將樣本立即浸泡在 RNA 穩(wěn)定劑RNAwait溶液中���。
2.2 樣本破碎裂解不充分導(dǎo)致純化柱堵塞���。
建議:在組織研磨時(shí),請保證組織充分研磨����,并在研磨完成后迅速轉(zhuǎn)移至預(yù)先準(zhǔn)備好的裂解液RL或裂解液RSL(確認(rèn)已添加正確比例的
β-ME)中。
2.3 洗脫液添加不正確�����。
建議:確認(rèn)
RNase-Free 水滴加到了純化柱膜O型墊圈中央位置����。
2.4 漂洗液RW中沒有添加正確體積的無水乙醇。
建議:請按照說明書�����,在試劑盒使用前,漂洗液RW中添加正確體積的無水乙醇并混勻�����。
2.5 組織樣本用量不合適���。
建議:每
500 μl 裂解液RL或裂解液
RSL使用最大組織量50
mg�����,組織使用過多會導(dǎo)致
RNA 提取量降低并且得到的
RNA 純度也會降低���。我們強(qiáng)烈建議每單次 RNA提取操作,樣本初始用量一定不要超過最大建議量�。
2.6 洗脫體積不合適或洗脫不徹底。
建議:純化柱的洗脫液體積為
50-100 μl���;若洗脫效果并不理想,建議在加入65℃預(yù)熱的RNase-Free
水后���,延長常溫放置的時(shí)間�����,例如放置
5-10 min���。
2.7 純化柱在第二次RW洗滌之后有乙醇?xì)埩簟?
建議:漂洗液RW洗滌后���,吸附柱空甩離心2
min是關(guān)鍵步驟,以充分除去吸附柱上殘留的乙醇�。
2.8 試劑盒使用不正確。
建議:對于多酚多糖的植物樣本�,務(wù)必使用緩沖液PRS,這是我們專門針對多酚多糖植物樣本而研制的多糖多酚去除劑�,如不添加,將導(dǎo)致RNA不能掛柱或提取到純度不高的RNA����。
3. 純化獲得的RNA有降解
純化得到的
RNA 的質(zhì)量和樣本的保存、RNase
污染�����、操作等因素有關(guān)���。
常見原因分析:
3.1 組織樣本采集后沒有及時(shí)保存����。
建議:組織樣本在收集后若不及時(shí)使用,請立即低溫保存于液氮中或經(jīng)液氮速凍后立即轉(zhuǎn)移至-70℃長期保存�,或者將樣本立即浸泡在 RNA 穩(wěn)定劑
RNAwait溶液中。提取
RNA 請盡量使用新近采取的組織樣本�����。
3.2 組織樣本反復(fù)凍融�����。
建議:組織樣本保存時(shí)��,最好剪成小段保存����,使用時(shí)取出其中一部分即可,避免樣本的反復(fù)凍融導(dǎo)致
RNA 的降解�。
3.3 操作間有
RNase 引入或沒有佩戴一次性手套、口罩等�����。
建議:RNA
提取實(shí)驗(yàn)最好在單獨(dú)的
RNA 操作間進(jìn)行�����,并在實(shí)驗(yàn)前清理好實(shí)驗(yàn)桌�����,實(shí)驗(yàn)時(shí)佩戴一次性手套���、口罩��,最大程度上避免
RNase 引入導(dǎo)致的RNA
降解���。
3.4 試劑在使用過程中被
RNase 污染。
建議:更換新的植物總RNA
提取系列試劑盒進(jìn)行相關(guān)實(shí)驗(yàn)��。
3.5
RNA 操作時(shí)所用的離心管���、槍頭等有 RNase 污染�����。
建議:確認(rèn)
RNA 提取時(shí)所用到的離心管����、槍頭、移液器等都是
RNase-Free����。
4. RNA中含有DNA污染
4.1 提取的起始材料超過50 mg
建議:步驟1-樣品處理時(shí)用天平稱取粉末重量,不要超過50
mg�����,否則樣品的核酸量會超過DNA清除柱CS的處理極限����,導(dǎo)致洗脫下的RNA有基因組DNA的污染。
4.2 省略了步驟3-去除基因組污染步驟���。
建議:步驟3-去除基因組污染步驟必不可少�����,不能省略���。DNA清除柱CS能極大限度的去除上清液中的基因組
DNA,使用裂解液RL
plus洗脫下的RNA基本無基因組DNA的污染�����。
4.3 跳過了使用去蛋白液RD的漂洗步驟(見操作步驟第6步)。
建議:這一步驟對于除去殘留的
DNA 以及雜質(zhì)蛋白十分重要��,一定不能省略���,否則將會導(dǎo)致純化得到的
RNA 中含有DNA
污染和蛋白污染。
5. 純化獲得的RNA影響下游實(shí)驗(yàn)
經(jīng)吸附柱純化的
RNA�����,如果鹽離子���、蛋白質(zhì)含量過多會影響下游實(shí)驗(yàn)�,比如:逆轉(zhuǎn)錄�����、Northern
Blot 等�����。
1. 洗脫后的
RNA 有鹽離子殘留���。
建議:確認(rèn)漂洗液RW中添加了正確體積的乙醇����,并按操作說明的離心轉(zhuǎn)速進(jìn)行2次RW洗滌吸附柱 (見操作步驟第7,8步)���。
2. 洗脫后的
RNA 有乙醇?xì)埩簟?
建議:確認(rèn)
RW第二次洗滌后�,按操作說明的對吸附柱進(jìn)行空管離心操作(見操作步驟第9
步)���,如果還有乙醇?xì)埩?�,可以將空管離心后吸附柱開蓋常溫放置
5 min���,以最大程度上去除乙醇?xì)埩簟?